国家医疗器械不良事件监测年度报告 (2022年) |
 |
为全面反映2022年我国医疗器械不良事件监测工作情况,国家药品不良反应监测中心编撰了《国家医疗器械不良事件监测年度报告(2022年)》。
一、医疗器械不良事件监测工作进展
2022年,落实“四个最严”总体要求,严格按照《医疗器械不良事件监测和再评价管理办法》(以下简称《办法》)有关规定,坚持“科学评价为基础,风险管理为主线,服务患者为中心”,持续加强制度体系建设,探索医疗器械警戒制度研究,不断拓展宣传培训方式,深入研究监测评价新工具、新标准、新方法,全面提升风险预警和处置能力,医疗器械不良事件监测工作取得了新的进展:
(一)持续夯实报告收集基础,继续扩大系统覆盖用户
2022年,国家医疗器械不良事件监测信息系统接收到医疗器械不良事件报告69万余份,每百万人口平均报告数为493份。28个省(自治区、直辖市)的医疗器械不良事件报告县级覆盖率达到100%。医疗器械不良事件监测信息系统基层注册用户数量持续提升,达到39万余家,其中医疗器械注册人达31,648家。
(二)系统开展产品风险评价,全面推进重点监测工作
2022年,全国医疗器械不良事件评价处置工作持续开展,系统运用日常监测、预警分析及季度汇总等手段,确保及时发现、评价并处置风险。对国外监管机构采取的风险控制措施进行监测,根据发现风险的情况,全年共发布12期《医疗器械警戒快讯》。按工作方案要求全面推进重点监测工作,审核37个医疗器械品种不良事件重点监测实施方案,认定105家第一批国家医疗器械不良事件监测哨点,组织召开重点监测专家研讨及工作推进会,全方位保障重点监测工作的顺利开展。
(三)广泛进行宣传培训,持续开展专项检查
2022年,国家药品不良反应监测中心与中国医疗器械行业协会合作举办了第六届中国医疗器械警戒大会,举办了1期医疗器械不良事件监测核心技术研修班,配合国家局开展家用医疗器械座谈会,吸引了知名学者、业界专家、企业代表、监测从业人员、用械人群的广泛参与和讨论。国家药品不良反应监测中心组织对18家企业开展了医疗器械不良事件监测专项检查,并督促医疗器械注册人备案人对检查发现的缺陷完成整改。
(四)深入探索警戒制度研究,积极参与国际交流合作
2022年,国家药品不良反应监测中心承担中国药品监管科学行动计划第二批重点项目医疗器械警戒技术和方法研究,聚焦医疗器械警戒制度研究和高风险、植入类医疗器械主动监测中的关键技术,持续提高警戒智能化和现代化监测评价能力。国家药品不良反应监测中心积极参加国际医疗器械监管机构论坛(IMDRF)相关会议,有序开展“国家监管机构报告(NCAR)”信息交换工作,持续跟踪“不良事件术语和编码(AET)”项目组工作进展,促进医疗器械不良事件监测工作国际交流与合作。
二、全国医疗器械不良事件报告总体情况
(一)年度报告总体情况
1.全国医疗器械不良事件报告数量。2022年,国家医疗器械不良事件监测信息系统共收到医疗器械不良事件报告694,866份,比上年增加6.79%(图1)。
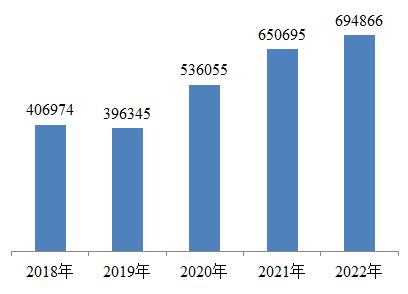
图1 2018-2022年全国医疗器械不良事件报告数量

2.每百万人口平均报告数量。2022年,我国每百万人口平均医疗器械不良事件报告数为493份,比上年增加6.94%(图2)。

图2 2018-2022年全国每百万人口平均医疗器械不良事件报告数比较
(二)注册基层用户数量
截至2022年12月31日,在国家医疗器械不良事件监测信息系统中注册的基层用户(包括注册人和备案人(以下简称注册人)、经营企业和使用单位)共397,561家,比上年增长5.43%。其中注册人31,648家,比上年增长7.51%,占用户总数的7.96%;经营企业234,836家,比上年增长7.06%,占用户总数的59.07%;使用单位131,077家,比上年增长2.17%,占用户总数的32.97%(图3)。
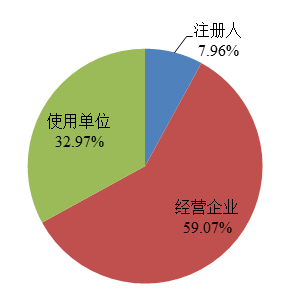
图3 2022年国家医疗器械不良事件监测信息系统注册基层用户情况
注:《办法》要求注册人“应当注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息,报告医疗器械不良事件”。国家和省级监测机构开展培训、检查等工作,督促注册人在系统注册并维护产品信息,这是注册人开展医疗器械风险评价落实主体责任的前提。
三、全国医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2022年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,使用单位上报607,551份,占报告总数的87.43%;注册人上报16,100份,占报告总数的2.32%;经营企业上报70,877份,占报告总数的10.20%;其他来源的报告338份,占报告总数的0.05%(图4)。
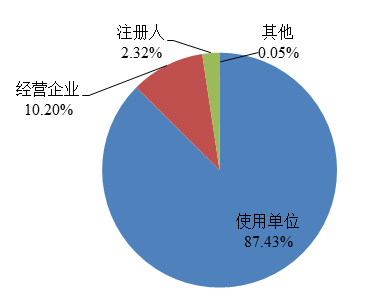
图4 2022年医疗器械不良事件报告来源情况
(二)按事件伤害程度统计分析
上报死亡的可疑不良事件报告153份,占报告总数的0.02%,未发现不良事件与涉及医疗器械存在明确相关性;上报严重伤害的可疑不良事件报告45,012份,占报告总数的6.48%;上报其他伤害的可疑不良事件报告649,701份,占报告总数的93.50%(图5)。
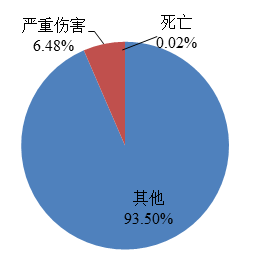
图5 2022年医疗器械不良事件报告涉及事件伤害程度情况

(三)按医疗器械管理类别统计分析
2022年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告244,154份,占报告总数的35.14%;涉及Ⅱ类医疗器械的报告329,732份,占报告总数的47.45%;涉及Ⅰ类医疗器械的报告58,057份,占报告总数的8.36%;未填写医疗器械管理类别的报告62,923份,占报告总数的9.06%。(图6)。
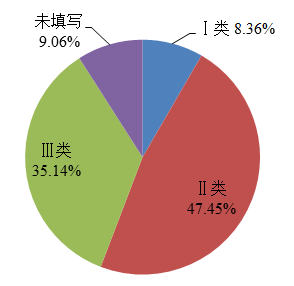
图6 2022年医疗器械不良事件报告涉及医疗器械管理类别情况

(四)按医疗器械分类目录统计分析
2022年,国家医疗器械不良事件监测信息系统收到的医疗器械不良事件报告涉及了医疗器械分类目录中的所有类别。其中,报告数量排名前十位的医疗器械类别见表1。
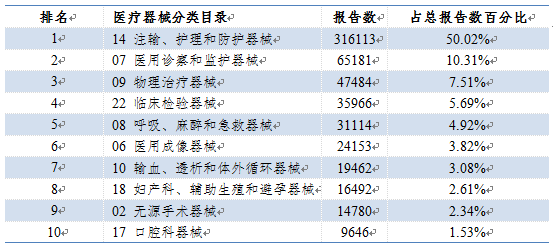
表1 2022年医疗器械不良事件报告涉及医疗器械分类目录情况
(五)按医疗器械结构特征统计分析
2022年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,涉及无源医疗器械的报告448,422份,占报告总数的64.53%;涉及有源医疗器械的报告178,003份,占报告总数的25.62%;涉及体外诊断试剂的报告5,513份,占报告总数的0.79%;未填写医疗器械结构特征的报告62,928份,占报告总数的9.06%(图7)。
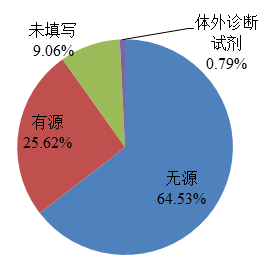
图7 2022年医疗器械不良事件报告涉及医疗器械结构特征情况
(六)按实际使用场所统计分析
2022年,国家药品不良反应监测中心收到的医疗器械不良事件报告中,使用场所为“医疗机构”的报告614,059份,占报告总数的88.37%;使用场所为“家庭”的报告64,696份,占报告总数的9.31%;使用场所为“其他”的报告16,111份,占报告总数的2.32%(图8)。
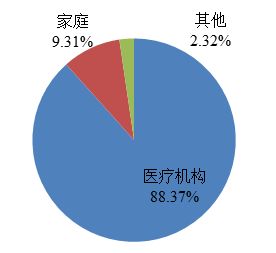
图8 2022年医疗器械不良事件报告涉及实际使用场所情况
四、医疗器械警戒快讯发布情况
2022年,国家药品不良反应监测中心密切跟踪全球医疗器械监管情况,发布12期《医疗器械警戒快讯》,汇总了美国、英国、澳大利亚以及加拿大发布的包括呼吸机、吻合器、覆膜支架、除颤仪、新型冠状病毒检测试剂等医疗器械在内的共86条安全性信息,为我国开展相关医疗器械的安全性评价和风险控制提供参考借鉴。
五、有关情况说明
(一)与大多数国家一样,我国医疗器械不良事件报告通过自发报告系统收集并录入到数据库中,即当怀疑某种事件可能与医疗器械有关时,就可以上报。受报告者主观意识、经验水平、认知程度、甚至所持立场等影响,医疗器械不良事件的报告可能存在片面性和局限性,如伤害程度判读不准确、报告填写不规范、信息不完善等,甚至将与医疗器械无关的事件也按照不良事件上报,因此统计结果可能与实际发生的医疗器械不良事件情况存在偏差。
(二)不同医疗器械的不良事件报告数量受使用数量、风险程度、报告意识等诸多因素影响,因此报告数量的多少不直接代表医疗器械不良事件发生率的高低或者风险严重程度。
(三)上述统计数据来源于国家医疗器械不良事件监测信息系统中2022年1月1日至2022年12月31日接收的数据,统计中由于四舍五入的进位规则,可能会出现百分比加和不等于100%的情况。
(四)本年度报告完成时,部分严重伤害医疗器械不良事件报告尚处在调查和评价的过程中,因此统计结果为统计时数据收集情况的真实反映,并不代表医疗器械安全性评价的最终结论。
小贴士
1.医疗器械:是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(1)疾病的诊断、预防、监护、治疗或者缓解;
(2)损伤的诊断、监护、治疗、缓解或者功能补偿;
(3)生理结构或者生理过程的检验、替代、调节或者支持;
(4)生命的支持或者维持;
(5)妊娠控制;
(6)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
2.医疗器械不良事件监测:是指对医疗器械不良事件的收集、报告、调查、分析、评价和控制的过程。
3.医疗器械不良事件:是指已上市的医疗器械,在正常使用情况下发生的、导致或者可能导致人体伤害的各种有害事件。
4.死亡医疗器械不良事件报告:指患者最终结果为死亡的医疗器械不良事件报告。不表示患者的死亡与使用医疗器械有明确的关联性。
5.医疗器械不良事件报告原则:报告医疗器械不良事件应当遵循可疑即报的原则,即怀疑某事件为医疗器械不良事件时,均可以作为医疗器械不良事件进行报告。报告内容应当真实、完整、准确。
导致或者可能导致严重伤害或者死亡的医疗器械不良事件应当报告;创新医疗器械在首个注册周期内,应当报告该产品的所有医疗器械不良事件。
6.国家医疗器械不良事件监测信息系统注册要求:注册人、经营企业和二级以上医疗机构应当注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息,报告医疗器械不良事件。注册人应当持续跟踪和处理监测信息;产品注册信息发生变化的,应当在系统中立即更新。鼓励其他使用单位注册为国家医疗器械不良事件监测信息系统用户,报告医疗器械不良事件相关信息。
医药网新闻
- 相关报道
-
- 从免陪照料到智能医疗 粤病院立异服务加强医护协同效能 (2025-05-09)
- 投资超20亿元 罗氏制药在上海浦东新建临盆基地 (2025-05-09)
- 有前提的二级及以上综合病院要开设老年医学科 (2025-05-09)
- 海南自贸港扩展开放匆匆医药家当倒退 (2025-05-08)
- 黄果在上海、江苏等地调研推动医药家当数智化转型 (2025-05-07)
- 江西省医保医用耗材付出治理目次(2025年) (2025-05-07)
- 医疗东西成“银发族”安康礼单“新宠” (2025-05-06)
- 你想晓得的生养保险政策都在这里!一文读懂→ (2025-05-06)
- 海南推出“工信8+2”政策系统 加码支持生物医药高质量倒退 (2025-04-30)
- 药易购一季度净利腰斩,转型“虚火”难掩盈利困局 (2025-04-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















