研究开发金属结合蛋白组学分析新方法 |
 |
来源:北大 2024-04-18 09:59
METAL-TPP为金属蛋白质组研究提供了有力的工具,扩展了人们对金属结合蛋白多样性和复杂性的理解。通过揭示金属离子在细胞内的具体生化功能,为开发新的疾病治疗策略提供参考。近日,北京大学化学与分子工程学院、北大-清华生命联合中心、北京大学合成与功能生物分子中心的王初教授课题组与北京大学生命科学学院、蛋白质与植物基因研究国家重点实验室、北大-清华生命联合中心的肖俊宇教授课题组合作,在Nature Chemical Biology杂志上发表了题为的研究文章。在这项工作中,作者开发了一种名为METAL-TPP的实验方法,采用热稳定性组学分析技术在蛋白质组学水平研究了金属解离诱导的蛋白热稳定性扰动,为研究金属蛋白质组和金属生物学提供了新的实验分析工具。
金属离子在生物体内扮演着重要角色,如参与酶催化作用、维持细胞结构稳定、参与物质运输及信号转导等,全面了解金属离子与哪些蛋白质结合以及这些结合对生物功能的影响具有重要科学意义,但在组学水平发现和鉴定金属蛋白仍然具有挑战。
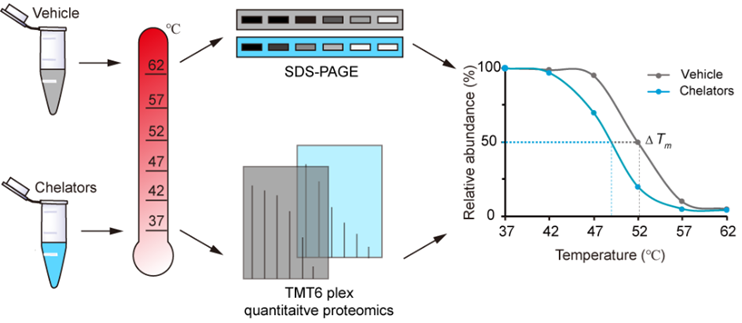
图1. METAL-TPP的原理
蛋白质在与其配体结合或解离后,热稳定性会出现变化。在该工作中,研究团队基于这一现象使用广谱的金属离子螯合剂EDTA从蛋白质组中剥夺金属离子,再使用定量质谱方法监测由此引起的蛋白质热稳定性变化。由于金属的缺失会导致蛋白质热稳定性降低,因此在质谱数据分析中显示热稳定性减少的那些蛋白是潜在的金属结合蛋白。通过将该策略应用于人类蛋白质组,研究人员不仅鉴定到一些已知的金属结合蛋白,还发现了一批之前没有注释有金属结合活性的潜在金属结合蛋白。同时,研究人员也选择了一个具有重要生物功能的潜在金属结合蛋白GFPT2进行了深入的生化验证,将金属调控与细胞内己糖合成通路联系起来。
总的来说,METAL-TPP为金属蛋白质组研究提供了有力的工具,扩展了人们对金属结合蛋白多样性和复杂性的理解。通过揭示金属离子在细胞内的具体生化功能,为开发新的疾病治疗策略提供参考。该实验方法可以与王初课题组去年发表的一篇利用机器学习预测金属结合位点的计算方法【Nat. Chem. Biol.2023, 19 (5), 548 555】结合起来,用于系统地发现和鉴定不同物种中的金属结合蛋白,为金属蛋白的生物学功能提供重要线索。
北京大学前沿交叉学科研究院北大-清华生命联合中心2022届博士毕业生曾欣、2021届博士毕业生魏田田、化学与分子工程学院2019级博士生王相贺以及王初课题组副研究员刘源为该文的共同第一作者。王初和肖俊宇为该工作的共同通讯作者。该工作得到国家委、科技部和北京科学分子国家研究中心的支持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Redox Biology:"血小板‘制动器’升级,塔尔卡大学的研究者们揭示了调节线粒体功能提高抗血小板作用 (2024-05-01)
- 国度药监局对于宣布《化妆品查看治理方法》的布告 (2024-04-30)
- 《化妆品查看治理方法》系列解读(一) (2024-04-30)
- Nature子刊:复旦大学研究发现,这种饮食方式,有益大脑健康,脑容量更大 (2024-04-30)
- 在非临床人群中揭示稀有变异的累积效应:对认知和社会经济特征的影响 (2024-04-30)
- 《自然·心血管研究》:刷新认知!脑膜淋巴管竟不影响Aβ清除? (2024-04-30)
- 司美格鲁肽注射液 (2024-04-29)
- Science子刊:新研究揭示铁蛋白升高引起肝脏炎症机制 (2024-04-29)
- 亚硒酸盐选择性杀死肺成纤维细胞治疗博来霉素诱导的肺纤维化 (2024-04-29)
- 2024年医保基金航行查看初次展开“转头看” (2024-04-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















