《自然·通讯》:武汉大学团队发现,免疫细胞释放的特定外囊泡竟会助长肿瘤气焰! |
 |
来源:奇点糕 2024-05-16 09:12
研究团队利用HNSCC患者血液样本发现,同时结合循环sEVs上的PD-L1、PD-1、CD80水平进行分析,相比于单独指标,用于预测PD-1抑制剂治疗反应的效果更佳。武汉大学的陈刚团队于近日发表在《自然 通讯》杂志上的最新研究[1],首次揭示携带检查点蛋白PD-1和CD80的sEVs在抗过程中扮演的角色。
他们发现,由T细胞产生的PD-1/CD80阳性sEVs能够引导表达的PD-L1重新分布,使PD-L1内化并通过sEVs分泌至血液循环,从而导致全身的免疫抑制。同时,这些囊泡还能够降低肿瘤细胞的黏附和抗原呈递功能、损害免疫细胞的浸润,推动肿瘤发展为免疫 冷 表型。
同时监测循环sEV上的PD-1、CD80、PD-L1水平,能够更好地预测癌症患者对免疫治疗的反应。

论文首页截图
之前的研究表明,。除了PD-L1,尽管人们早在2017就已经在循环sEVs上找到PD-1、CD80的身影[2],但其功能在免疫治疗中的作用仍然是一片空白。
在这项研究中,陈刚团队首先从36位健康捐献者和46位头颈部鳞状(HNSCC)患者的外周血样本中提取sEVs,对其进行表征和定量分析。患者中有23名在肿瘤复发后接受过PD-1抑制剂治疗,部分患者对治疗反应不佳。
结果显示,所有测试的免疫检查点蛋白中,循环sEV上的PD-L1、PD-1、CD80水平高,被证明与HNSCC患病以及患者对PD-1抑制剂治疗无反应或治疗预后不良密切相关。
其中,研究团队发现,PD-1和CD80往往同时出现在同一个循环sEVs上。PD-L1虽然不与之同行,但在PD-L1阳性患者体内,PD-L1+sEVs与PD-1/CD80+sEVs水平呈正相关。
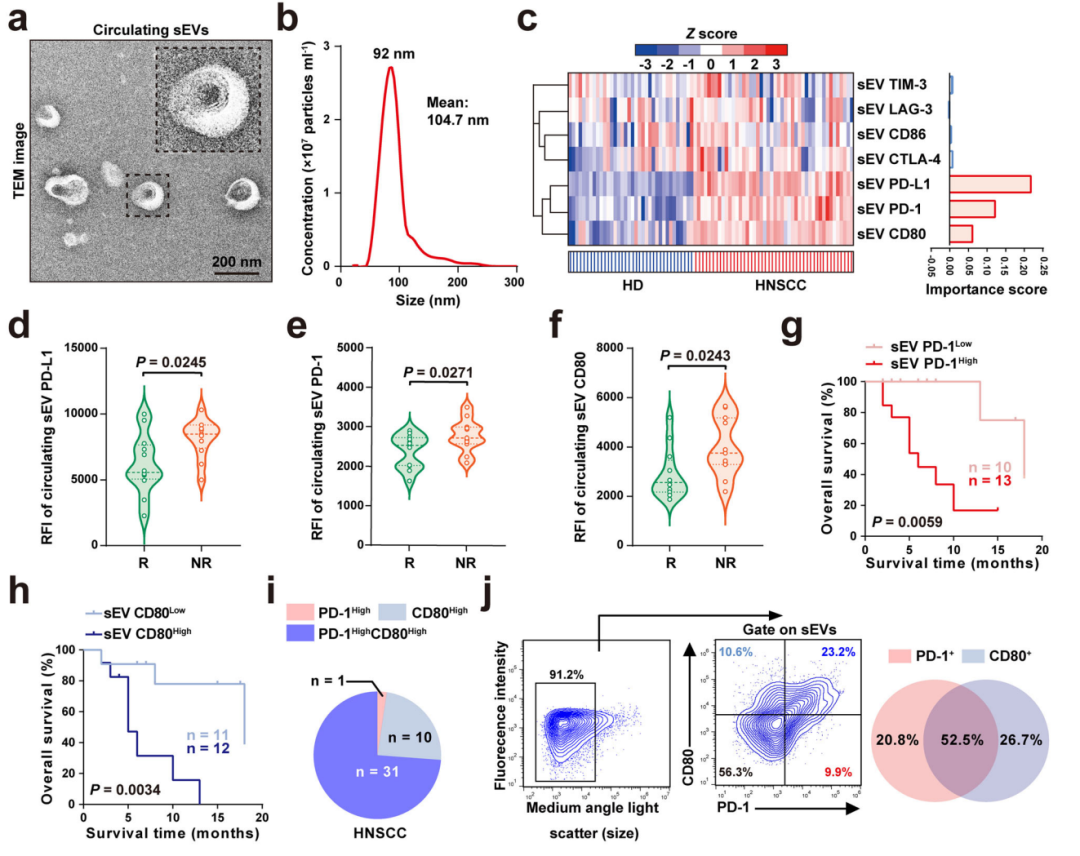
血液样本中PD-1/CD80阳性sEVs水平与HNSCC患者对免疫治疗的反应相关
研究团队在小鼠实验中对以上结果进行验证,并表明血液循环PD-1/CD80+sEVs的主要来源是活化T细胞,具有明显的免疫抑制特性。
从机制上来看,活化T细胞衍生的PD-1/CD80+sEVs在循环中遇到肿瘤细胞后,与其表面的PD-L1直接作用并激活肿瘤细胞内信号通路,通过ECSRT途径促使PD-L1等信号分子被内吞,并以sEVs装载的形式由肿瘤细胞分泌。PD-L1+sEVs进入血液循环,引起全身的适应性免疫抑制。
值得注意的是,陈刚团队在之前的工作中提出,IFN- 也会促使肿瘤细胞分泌PD-L1+sEVs[3]。但是此次经过对比,研究团队表示,PD-1/CD80+sEVs和IFN- 看似异曲同工,实则相背而行:
除了引起循环PD-L1+sEVs水平增加,PD-1/CD80+sEVs还有一项关键技能,即下调肿瘤细胞表面的PD-L1以及抗原提呈相关的MHC-I分子、细胞黏附相关的ICAM-1分子水平,从而降低肿瘤免疫原性和免疫细胞浸润,驱使肿瘤转变为免疫 冷 表型。与之不同,IFN- 的作用方式并不依赖于ECSRT内吞途径,反倒是会引起肿瘤细胞表达更多的PD-L1、MHC-I、ICAM-1,相当于给肿瘤 加热 。
而且与IFN- 处理相比,PD-1/CD80+sEVs促使肿瘤细胞分泌的PD-L1+sEVs还带有更多的 别吃我 信号CD47,表明巨噬细胞对其清除效率更低。再加上脂双分子层的特殊结构保护,PD-1/CD80+sEVs相比于IFN- 能够在循环中更稳定和远距离迁移,产生更强的抗肿瘤免疫抑制作用。
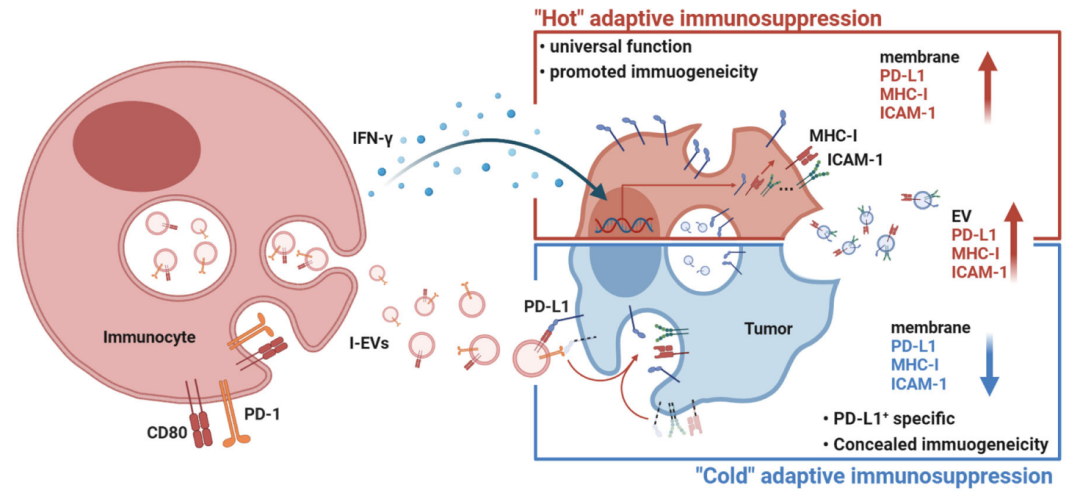
机制
给瘤小鼠或小鼠尾静脉注活化T细胞衍生的sEVs,会使小鼠肿瘤体积增长近一倍、小鼠寿命缩短,并明显减弱PD-1抑制剂的免疫治疗效果,导致肿瘤浸润CD8阳性T细胞数量减少;若在注射前预先处理,对其表达的PD-1/CD80进行阻断,可以挽救这些效果。
最后,研究团队利用HNSCC患者血液样本发现,同时结合循环sEVs上的PD-L1、PD-1、CD80水平进行分析,相比于单独指标,用于预测PD-1抑制剂治疗反应的效果更佳。并基于这些发现,他们提出了一个适用于临床实践的新工作流程,区分可能对免疫治疗有反应和无反应的患者,从而实现更有针对性的治疗策略。
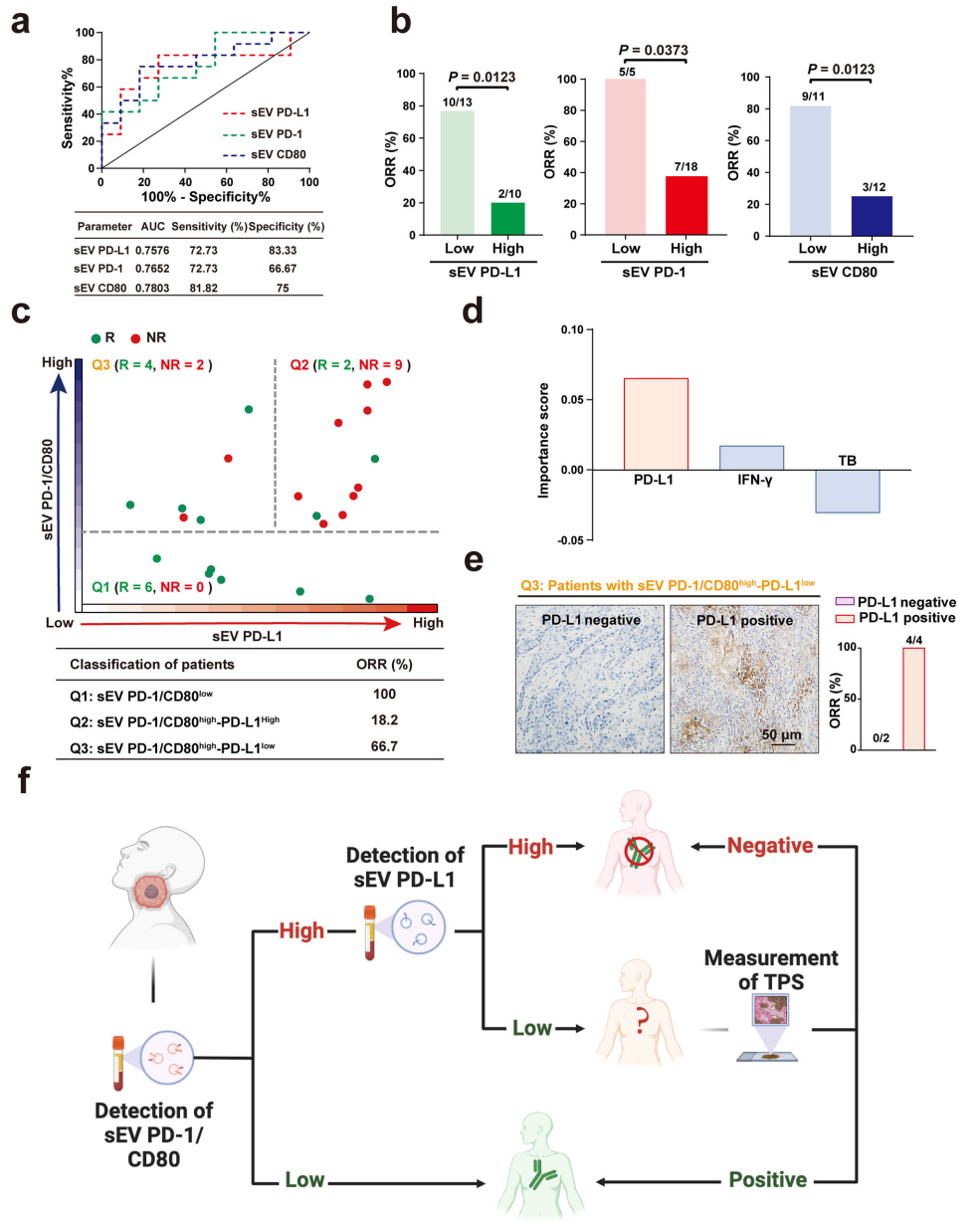
结合sEVs上的多个免疫检查点进行预测效果更佳
除了其抗肿瘤免疫抑制作用,研究团队推断,PD-1/CD80+sEVs还可能通过消耗PD-1抑制剂,降低其治疗效果。总之,更全面地了解循环sEV携带的多个免疫检查点,可能是克服免疫抑制和提高抗疗效的关键。
参考文献:
[1]Zhang, LZ., Yang, JG., Chen, GL. et al. PD-1/CD80+ small extracellular vesicles from immunocytes induce cold tumours featured with enhanced adaptive immunosuppression. Nat Commun 15, 3884 (2024). https://doi.org/10.1038/s41467-024-48200-9
[2]Ludwig, S. et al. Suppression of lymphocyte functions by plasma exosomes correlates with disease activity in patients with head and neck cancer. Clin. Cancer Res. 23, 4843 4854 (2017).
[3]Chen, G. et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature 560, 382 386 (2018).
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature Biotechnology (2024-06-01)
- Science:新研究揭示噬菌体与霍乱杆菌的比例可预测霍乱的严重程度 (2024-06-01)
- 登上Nature头条:华人学者揭开蟑螂的起源和入侵之谜 (2024-05-31)
- 造血干细胞研究进展(第13期) (2024-05-31)
- 突破性发现!Genome Med:人类帕金森疾病和炎性肠病之间的神秘遗传关联 (2024-05-31)
- 骨髓基质细胞诱导多发性骨髓瘤细胞染色质重塑导致转录变化 (2024-05-31)
- Science:利用AlphaFold2结构预测可指导潜在的候选药物发现 (2024-05-31)
- SORT (2024-05-31)
- Nature:新研究发现两条神经通路参与芬太尼成瘾 (2024-05-30)
- Nat Commun:通常与自身免疫性疾病相关的细胞类型和分子竟是肠道免疫系统的正常组成部分 (2024-05-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















